Manuel Montero Pérez Fontán, Francisco Pozo Piñón, Ramón Alfredo Infante Toribio, María Dolores Pardo Moreno, Juan María Pulido Duque (Hospital Universitario de Gran Canaria Doctor Negrín)
El síndrome de vena cava superior (SVCS) se produce por una obstrucción venosa severa en la vena cava superior. El origen más habitual son las neoplasias (70%) mientras que las estenosis benignas suponen en torno a un 30% de los casos. Dicha obstrucción eleva la presión venosa distalmente a la estenosis lo que genera la sintomatología de los pacientes. La velocidad de instauración, así como la presencia de colaterales, son variables que condicionan la severidad del cuadro. Salvo tumores significativamente radiosensibles como el linfoma o el cáncer de pulmón microcítico el tratamiento de elección son las prótesis endovasculares. Estas proporcionan un rápido alivio de los síntomas con baja tasa de complicaciones y permiten estudios posteriores anatomopatológicos para filiar la lesión, a diferencia de la radioterapia.
Introducción
El síndrome de vena cava superior (SVCS) se produce por una obstrucción venosa severa de la vena cava superior (VCS) que asocia habitualmente elevada morbimortalidad. Según diversos estudios y metaanálisis, la supervivencia media en los pacientes de etiología maligna se encuentra entre 3-6 meses, aunque depende en gran medida de la situación previa del paciente así como del tratamiento posterior recibido.
La causa más frecuente son las neoplasias malignas, aproximadamente un 70% de los casos, mientras que las causas benignas suponen un 30% en relación con el empleo creciente de catetéres venosos centrales y otros dispositivos cardíacos como marcapasos o desfibriladores automáticos implantables (DAI). La fibrosis mediastínica, secundaria a ciertas infecciones, enfermedades autoinmunes y radioterapia, de forma excepcional, puede ser responsable de un pequeño porcentaje de los casos.
Anatomía y fisiopatología
La vena cava superior se forma por la unión del tronco braquiocefálico derecho (TBCD) e izquierdo (TBCI) los cuales recogen el drenaje venoso de cabeza, cuello y extremidades superiores. En ella también desemboca la vena ácigos que conecta la VCS con la vena cava inferior (VCI) y sirve como vía de drenaje accesoria en caso de obstrucción de la VCS. Las venas mamarias internas, las venas torácicas y el plexo vertebral sirven como vía de drenaje adicional.
En condiciones normales el gradiente existente entre VCS y la aurícula derecha (AD) es mínimo (0-3 mmHg). Cuando existe una obstrucción del flujo la presión proximal a la estenosis se sitúa en torno a 20-40 mmHg, siendo este aumento responsable de la sintomatología del paciente.
El nivel de la obstrucción, así como la velocidad de instauración del cuadro son responsables de la severidad del cuadro. Obstrucciones que afecten a la desembocadura de la vena ácigos o por debajo de la misma tienen mayor repercusión clínica [2-3]. No existe un consenso en cuanto a la clasificación de las obstrucciones en el SVCS, no obstante una de las más empleadas es la clasificación de Stanford & Doty, que basándose en los hallazgos angiográficos, las clasifican en 4 tipos en función de la localización de la obstrucción, la presencia de drenaje venoso accesorio así como en la dirección del flujo venoso.

Clínica
El diagnóstico del SCVS es habitualmente clínico. La congestión del sistema venoso provoca síntomas variados, que se exacerban en decúbito supino. Estos pueden clasificarse en cervicales, torácicos y miembros superiores (edema y aparición de colaterales), faciales (edema, congestión nasal y edema periorbitario), laríngeos (tos, estridor respiratorio, disnea) o neurológicos (cefalea, visión borrosa o confusión), siendo el edema facial y la dilatación venosa cervical los síntomas más frecuentes.
En ocasiones, pacientes con SVCS de etiología maligna pueden presentar compromiso vital por el rápido aumento de presión venosa que desencadena síntomas respiratorios y neurológicos severos [3]. La rara asociación de esta entidad con tromboembolismo pulmonar genera un mayor compromiso hemodinámico y alteraciones en el intercambio gaseoso que resulta en una mayor morbi-mortalidad. La mortalidad media asociada a este síndrome se sitúa en torno al 0.3-0.5%, aunque en pacientes cuya etiología es maligna la expectativa de vida media es en torno a 6 meses.
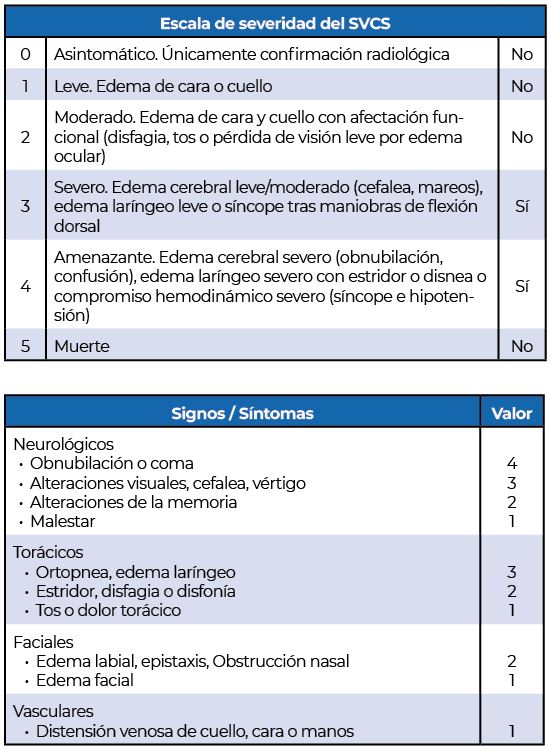
Con el fin de determinar la severidad del cuadro, así como la necesidad de tratamiento urgente existen distintas escalas de severidad clínica como la propuesta por Yu. et al [2, 5] la cual estadifica a los pacientes del 1 al 5 en función de los síntomas que presente el paciente (tabla 2). Otra escala de severidad empleada, la ¨Kishi Score¨ trata de establecer la gravedad del cuadro, así como la necesidad de tratamiento urgente en función del puntaje obtenido en la escala, que incluye síntomas neurológicos, laringo-faríngeos, faciales y cardiovasculares. Un valor igual o superior a 4 indica la necesidad de tratamiento urgente.
Diagnóstico diferencial
Las principales entidades a tener en cuenta en el diagnóstico diferencial clínico son el angioedema, reacciones alérgicas severas, insuficiencia tricuspídea, disfunción cardíaca derecha, pericarditis constrictiva, taponamiento cardíaco y el enfisema mediastínico. Las pruebas de imagen complementarias, así como una correcta anamnesis y valoración de los pacientes son fundamentales para establecer el diagnóstico correcto.
Pruebas complementarias
La radiografía de tórax es la primera prueba de imagen a realizar en casos de sospecha de SCVS. Aporta información sobre la presencia de lesiones sospechosas de malignidad, de derrame pleural, edema agudo de pulmón o de catéteres y otros dispositivos cardíacos.
La tomografía computerizada multidetector (TCMD) es la principal prueba no invasiva o de forma programada en pacientes con sospecha clínica del SVCS. Aporta importante información acerca del nivel de obstrucción, la posible causa del cuadro, la presencia de trombosis venosa y la existencia de colateralidad venosa. Esta implica una obstrucción clínicamente significativa mientras que su ausencia se relaciona con una obstrucción menos severa. Es fundamental como elemento previo a una intervención endovascular ya que aporta un mapa vascular fiable que ayuda al radiólogo intervencionista a lograr una adecuada recanalización y manejo del tratamiento.
La flebografía aporta información adicional sobre la anatomía, las características de la obstrucción y la severidad de la misma, así como la presencia de drenaje por colaterales y la dirección del flujo venoso. También ayuda a determinar con mayor fiabilidad que el escáner las dimensiones de las prótesis en caso de ser necesarias. No obstante es una prueba invasiva y se recomienda realizarla conjuntamente con el tratamiento terapeeútico.
La ecografía es otro método diagnóstico no invasivo importante que diagnostica de forma efectiva la presencia de trombosis venosa en la vena yugular, axilar o subclavia así como es una herramienta útil en el acceso venoso.
La cavografía y flebografía de miembros superiores ha quedado relegada al procedimiento terapéutico debido al gran desarrollo de técnicas no invasivas. Comparativamente con el angio-TC determina con gran fiabilidad el lugar de la obstrucción, la presencia de trombo asociado y es fundamental para valorar de forma adecuada el tamaño y la posición de la endoprótesis vascular.. No obstante no es útil para determinar con certeza la causa subyacente.
Tratamiento
Para un correcto abordaje del SVCS es fundamental un abordaje multidisciplinar e implica a oncólogos, radiólogos y, menos frecuentemente, cirugía torácica.
El manejo inicial consiste en medidas de soporte como la elevación de la cabeza con el fin de disminuir la presión hidrostática así como anticoagulación en caso de sospecha de trombosis venosa, glucocorticoides y diuréticos con el fin de aliviar el edema.
Los pacientes con sintomatología avanzada (grado IV y III según la escala Yu et al.) requieren diagnóstico mediante angio-TC, tratamiento urgente y habitualmente soporte hemodinámico. Estos pacientes requieren con más frecuencia anticoagulación y la realización de trombectomía mecánica previo despliegue de las prótesis. Los pacientes grado I y II son por definición pacientes clínicamente estables y cuyo tratamiento no requiere de medidas urgentes.
El tratamiento de elección, salvo excepciones, se realiza mediante endoprótesis metálicas endovasculares, no sólo proporcionan un rápido alivio de la sintomatología del paciente sino que presentan una alta tasa de efectividad con baja tasa de complicaciones. Además no interfiere en la toma de muestras para anatomía patológica a diferencia de la radioterapia la cual se reserva para tumores ya filiados y altamente radiosensibles (linfomas o cáncer de pulmón microcítico).
Aunque no existen estudios aleatorizados prospectivos del tratamiento endovascular del SVCS los estudios observacionales muestran un alto éxito técnico (80-98%) con mejoría de la sintomatología hasta en el 90% de los pacientes. Según distintos estudios las tasas de reestenosis se sitúan entre un 5%-29.5% y la recurrencia de la sintomatología entre 1.2%-20.5%.
El tratamiento endovascular se realiza bajo anestesia local aunque es necesario soporte hemodinámico en los pacientes con peor situación clínica. La vía femoral es la más utilizada, siendo recomendable el acceso venoso de miembros superiores para obtener imágenes angiográficas que ayuden a la recanalización y , en caso de ser necesario, desplegar las endoprótesis mediante un ¨through and through¨. La colocación de la endoprótesis ha de guardar al menos un margen de 10 mm respecto a la lesión estenótica y se pueden sobredimensionar hasta 2 mm respecto al calibre del vaso.
Tras superar la lesión se recomienda una predilatación con balones de angioplastia de pequeño calibre 2-4 mm de la zona estenótica e ir incrementando sucesivamente el tamaño de los mismos. Esto no sólo ayuda a implantar los stents venosos sino también a su correcta expansión. No obstante dilatar con balones de un calibre superior a 16mm no está recomendado dado que se asocia con posibilidad de rotura venosa así como de migración del stent.
En casos cuya etiología sea benigna, puede tratarse únicamente mediante angioplastia sin colocación de una endoprótesis siempre y cuando se resuelva dicha estenosis, desaparezca la circulación colateral y no exista trombosis asociada. No obstante, dada la naturaleza fibroelástica de este tipo de lesiones, son habituales los tratamientos múltiples y a medio plazo, la recidiva de las lesiones estenóticas y de la sintomatología.
En cuanto al posicionamiento de la endoprótesis hay distintas configuraciones válidas para un adecuado tratamiento de la sintomatología. En el caso de afectación de un tronco venoso braquiocefálico únicamente es necesaria la colocación ipsilateral de un stent, mientras que si ambos se ven involucrados habitualmente es necesaria una recanalización bilateral mediante la técnica de ¨Kissing stent¨ o ¨Y stent¨. No existen estudios aleatorizados que demuestren ventajas de una respecto a la otra y dependerá de la experiencia del operador así como de los materiales a disposición.
Tradicionalmente se han empleado endoprótesis metálicas autoexpandibles para el tratamiento de esta patología. En los últimos años se han empleado distintas endoprótesis metálicas de celda abierta, diseñados específicamente para patología venosa (Venovo, Bard; Abre, Medtronic; VICI, Boston Scientific) con excelentes resultados. Adicionalmente hay series de pacientes que han sido tratados con stents cubiertos con similares resultados terapéuticos. Tienen como ventaja menor probabilidad de reoclusión, dada la incapacidad del tumor de atravesar el stent, no obstante son más costosos y propensos a migrar, y no existen estudios que demuestren mejoría clínica o un aumento de la supervivencia respecto a las prótesis no cubiertas, por lo que su uso sigue siendo controvertido.
La presencia de trombosis en el momento del diagnóstico es un factor directamente relacionado con la reoclusión de la endoprótesis y por tanto es prioritario su tratamiento previo, mediante trombectomía mecánica o fármaco-mecánica, obteniendo los mejores resultados cuando se trata en menos de 5 días. La trombosis asociada a cuerpos extraños como catéteres o dispositivos cardíacos habitualmente se asocia a una evolución más precoz de los síntomas por lo que su tratamiento habitualmente es menos complejo que en estenosis de evolución crónica].
No existe indicación para la terapia anticoagulante de forma sistemática en el SVCS y esta se reserva para casos en los que se asocia trombosis o a dispositivos externos dado el mayor riesgo de recidiva. Además debe ser evaluado el riesgo hemorrágico de forma individualizada y, salvo que existan otras patologías que requieran de anticoagulación permanente, esta debe ser mantenida durante al menos durante 3 meses.
Complicaciones
En función de las series analizadas la tasa de complicaciones varían entre 0% y un 19% de los casos, siendo la mayoría complicaciones menores como hematomas o infección en la zona de punción. Las complicaciones mayores incluyen migración, reoclusión o rotura de la endoprótesis, rotura de una vena central, taponamiento cardíaco, hemotórax, edema de pulmón, lesión cardíaca o tromboembolismo pulmonar y su prevalencia se sitúa entre 0-8% de los pacientes. La mortalidad en casos de SVCS se sitúa en torno al 2% y esta aumenta en pacientes con necesidad de tratamiento urgente, así como en pacientes sometidos a radioterapia previa, asociación con tromboembolismo pulmonar o patología grave concomitante.
La complicación más temida es una rotura venosa con sangrado hacia cavidad torácica o al pericardio que resulta en una elevada morbi-mortalidad, la detección precoz de dicha complicación y el tratamiento con catéter-balón o endoprótesis cubierta son medidas fundamentales para tratarla. Gracias al desarrollo de nuevas endoprótesis metálicas dedicadas a patología venosa la tasa de rotura de las mismas, así como de migración han disminuído significativamente. En caso que esto suceda puede retirar la endoprótesis mediante un lazo o reposicionarlo con un catéter balón.
Conclusión
El SVCS, aunque es una entidad poco habitual, puede tener graves consecuencias si no se trata de forma adecuada. Debemos tener en cuenta que el incremento en dispositivos endovasculares ha aumentado la prevalencia de la misma y probablemente siga haciéndolo en el futuro. La terapia endovascular está consolidada como el tratamiento de elección. Las nuevas endoprótesis vasculares, los dispositivos de trombectomía y la valoración integral y multidisciplinar de los pacientes han conseguido mejorar la clínica y la calidad de vida de estos pacientes.
Escenarios Clínicos
Paciente 1
Varón de 64 años sin factores de riesgo cardiovascular con antecedentes de sarcoma pleomórfico desdiferenciado en muslo derecho intervenido en Mayo/21 con radioterapia adyuvante. Presenta un TEP en el diagnóstico que se resuelve con anticoagulación. Presenta recidiva intervenida en Abril/22 así como aparición de una masa apical derecha sospechosa de metástasis.
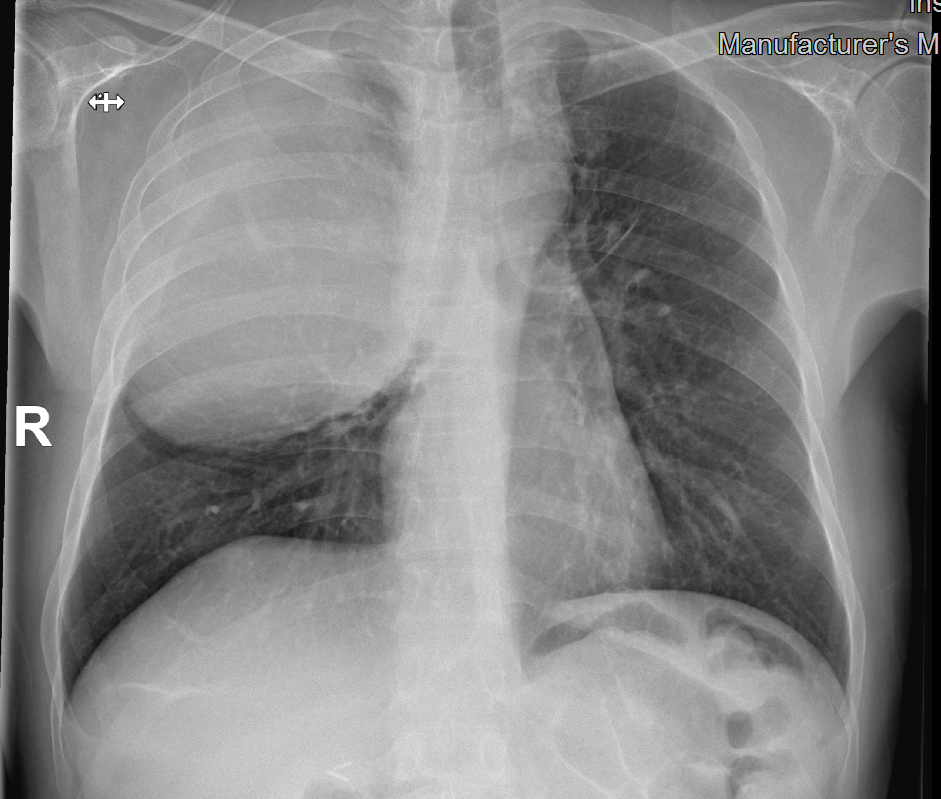
Acude al servicio de urgencias del Hospital Universitario de Gran Canaria Doctor Negrín con disnea en reposo, deterioro del estado general, disfonía, disfagia y edema cervico-facial y de miembros superiores en relación con síndrome de vena cava superior.
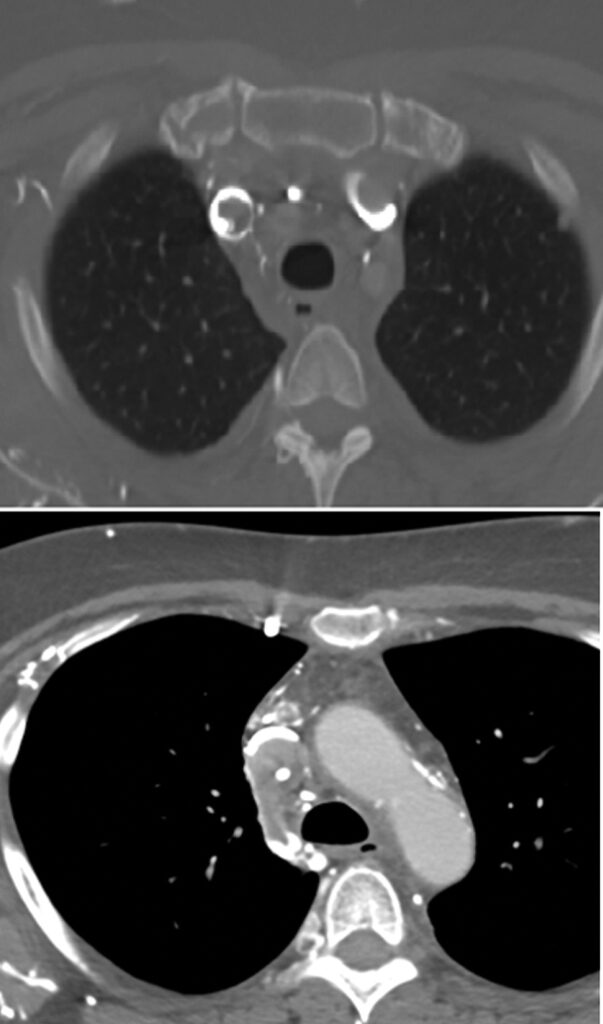
Se realiza Angio-TC que confirma la presencia de una masa mediastínica que condiciona oclusión del tronco braquiocefálico derecho y estenosis suboclusiva del izquierdo.
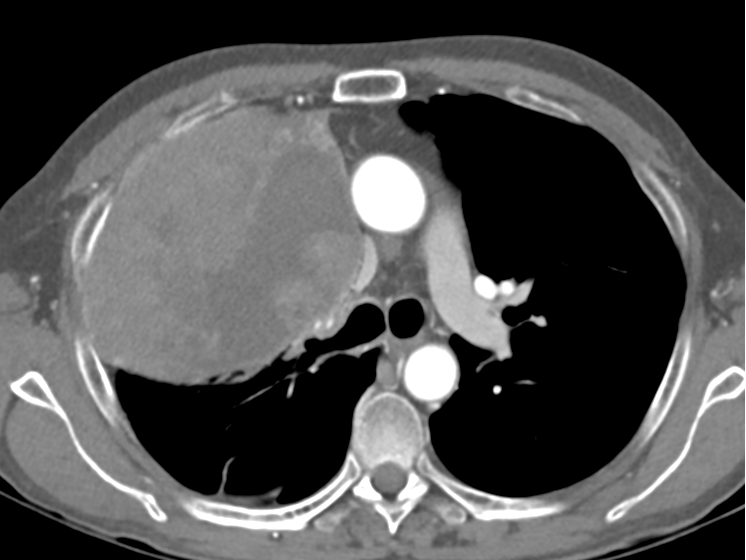
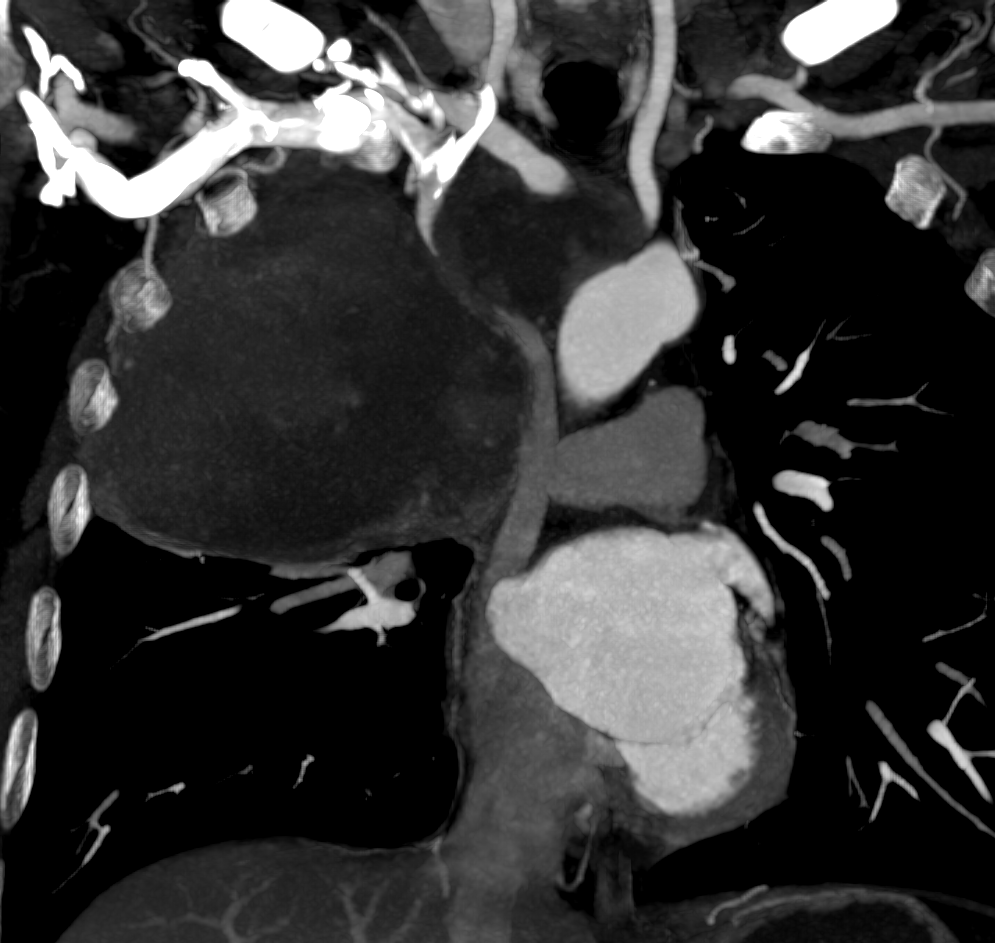
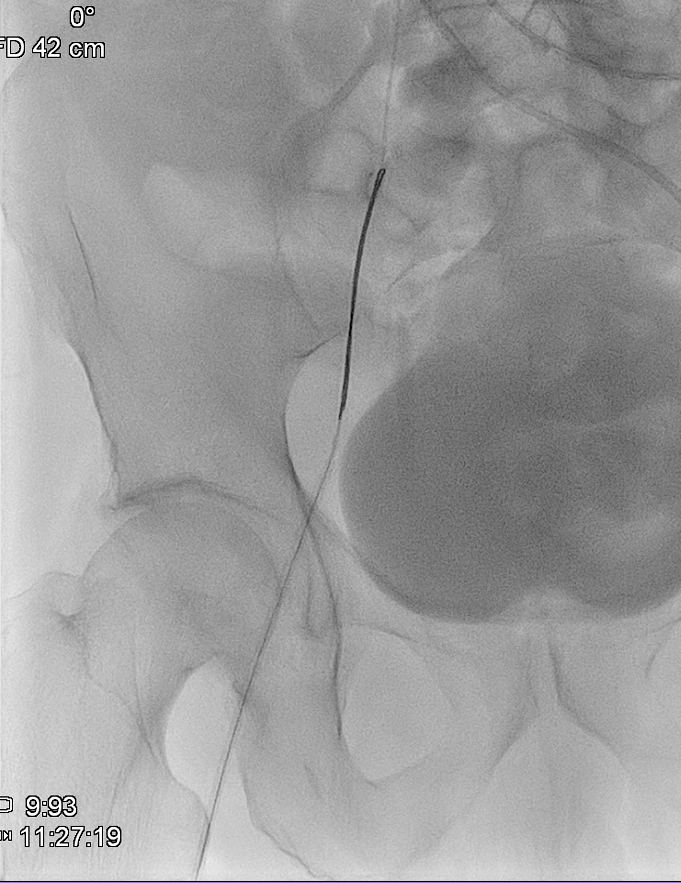
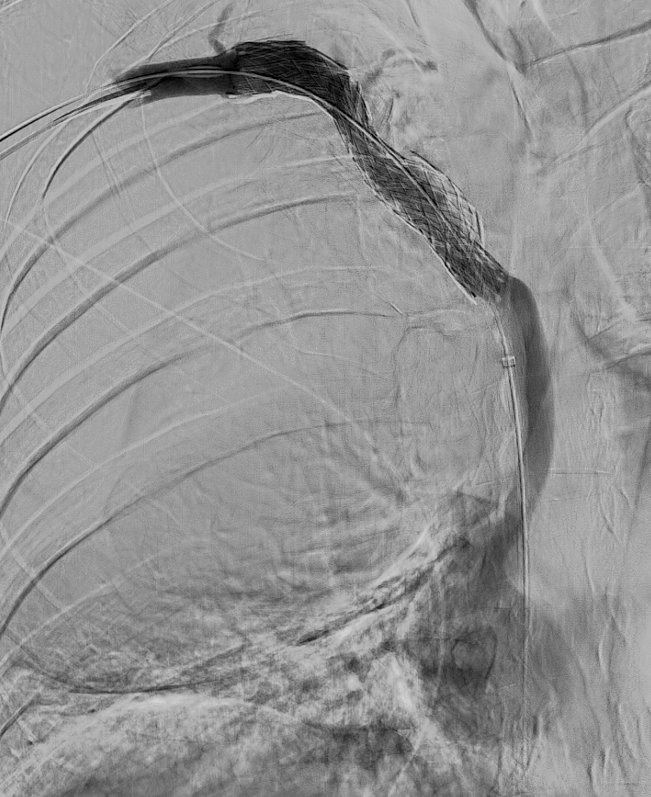
El día del procedimiento, previa colocación del stent se realiza venografía para delimitar anatómicamente la oclusión y determinar dimensiones del stent. Se identifica obstrucción completa del TBCI, compresión de la VCS y estenosis crítica en TBCD.
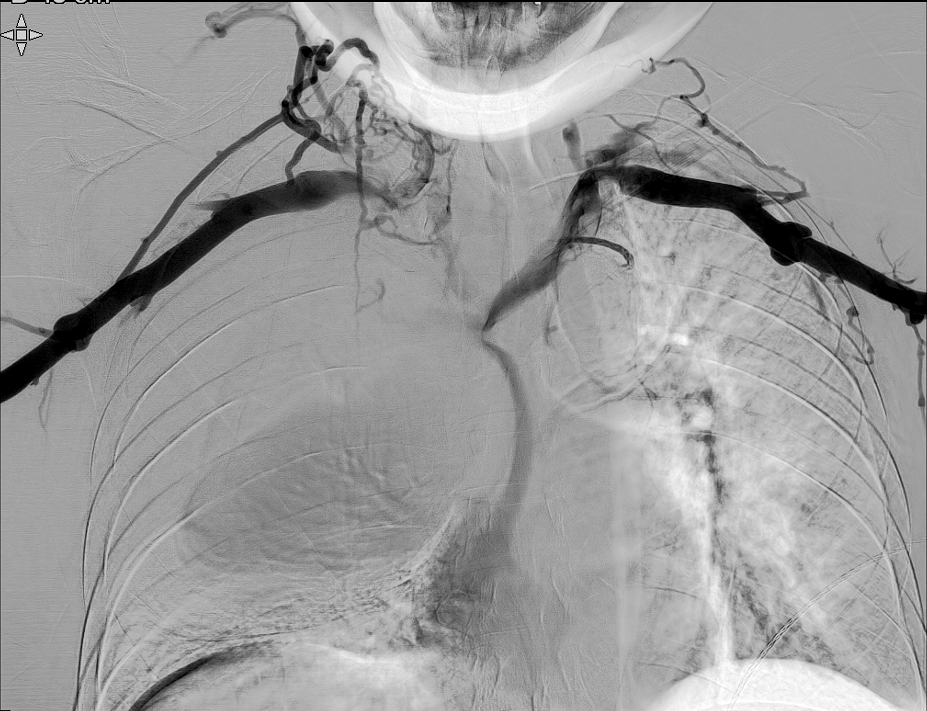
Se logra recanalizar oclusión mediante abordaje venoso femoral y braquial empleando técnica ¨through and through¨ y tras dilatación progresiva mediante balón de angioplastia se decide la colocación de stents bilaterales venosos Abre (Medtronic) de 14mm x 100mm (TBCD) y de 14mm x 120mm (TBCI) con buen resultado en control y desaparición de la colateralidad. Dada la afectación bilateral se decide implantar stents en ¨Y¨
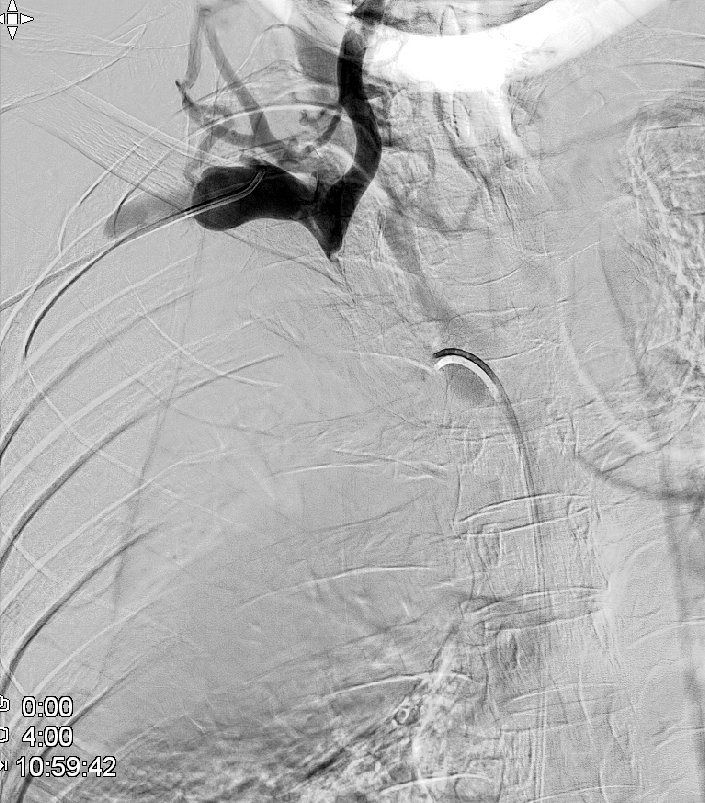
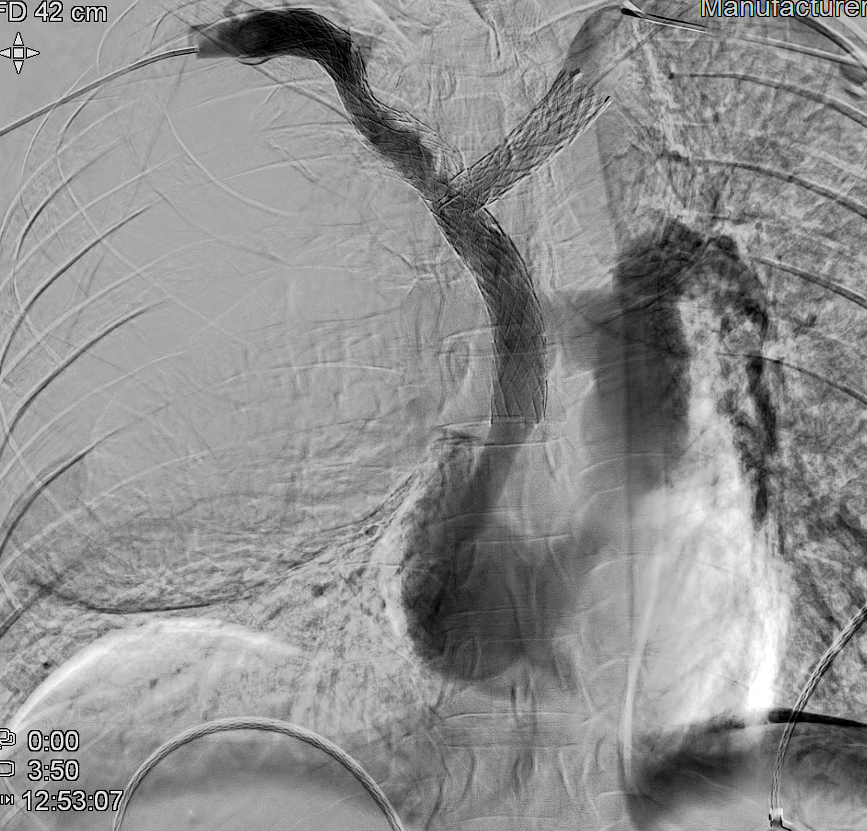
El procedimiento concluye sin incidencias y en 24-48 horas se produce importante mejoría significativa con disminución del edema cervical y de miembros superiores así como de la disnea y disfagia.
Paciente 2
Mujer de 36 años sin antecedentes personales de interés, derivada de Lanzarote con reciente diagnóstico de neoplasia maligna pulmonar derecha. La paciente presenta edema facial y de miembros superiores, disnea y congestión venosa cervico-facial.
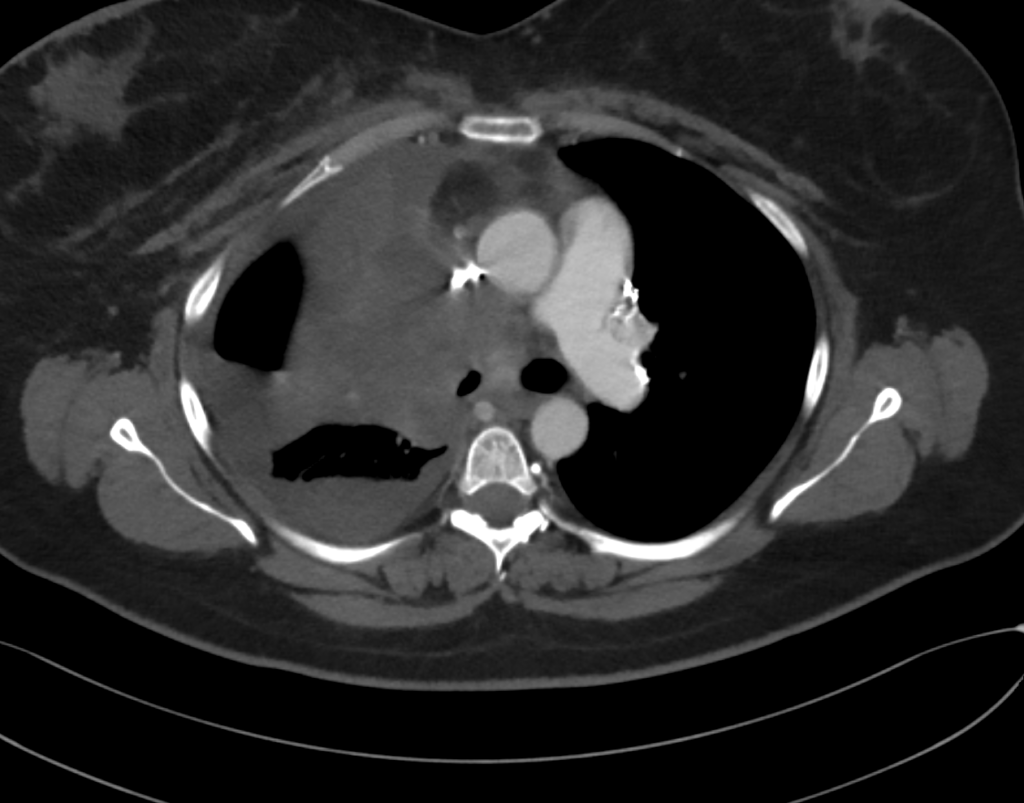
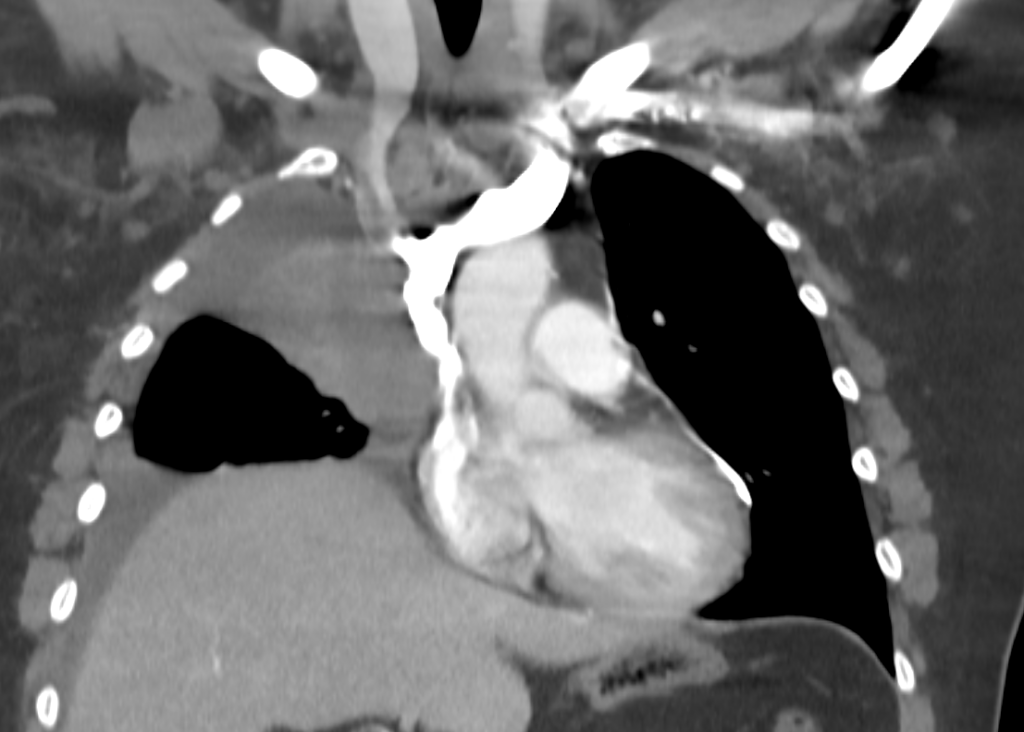
En el angioTC se identifica neoplasia pulmonar derecha que condiciona estenosis significativa de VCS. No se identifica estenosis significativa de TBCD ni izquierdo.
Se realiza venografía donde se confirman hallazgos descritos en el AngioTC.
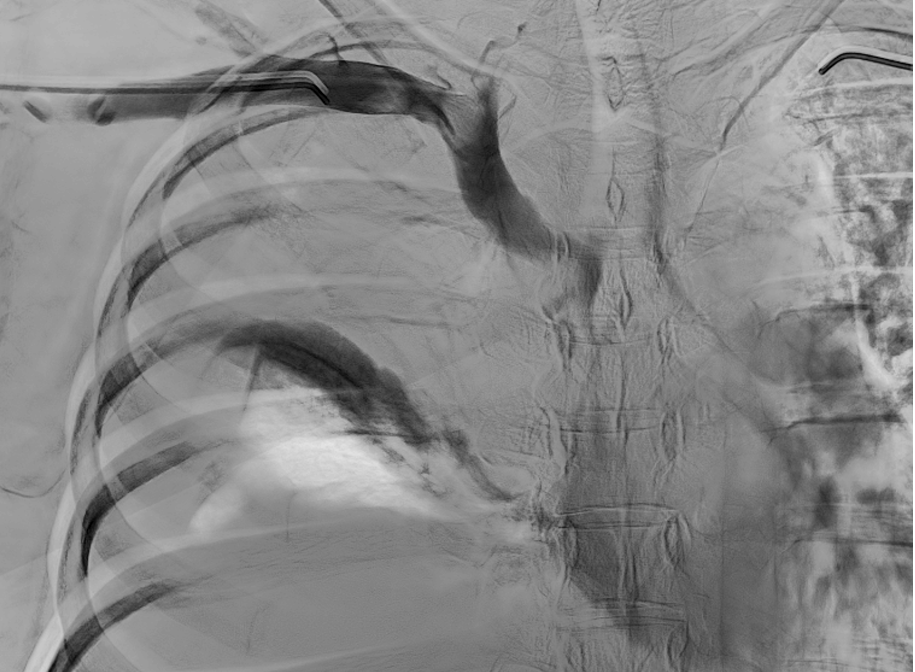
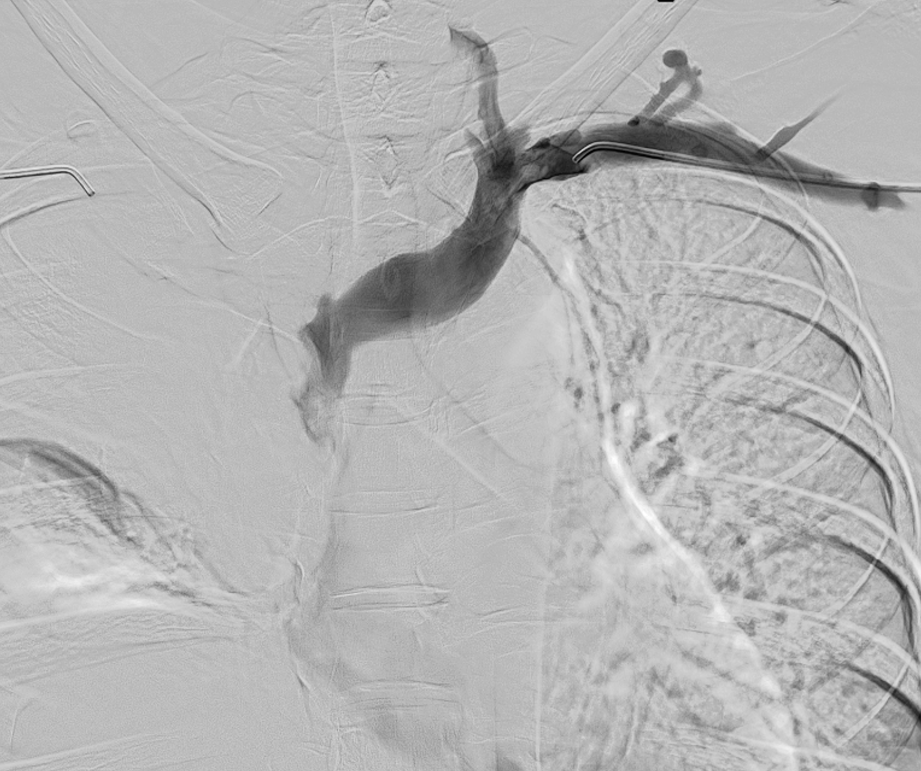
Se sobrepasa estenosis y ,debido a la afectación única de la VCS, se coloca stent venoso Abre (Medtronic) en VCS con extensión a TBCD con buen resultado en control final.
La paciente presenta buena evolución clínica y puede volver a su hospital de origen para continuar con el tratamiento oncológico.
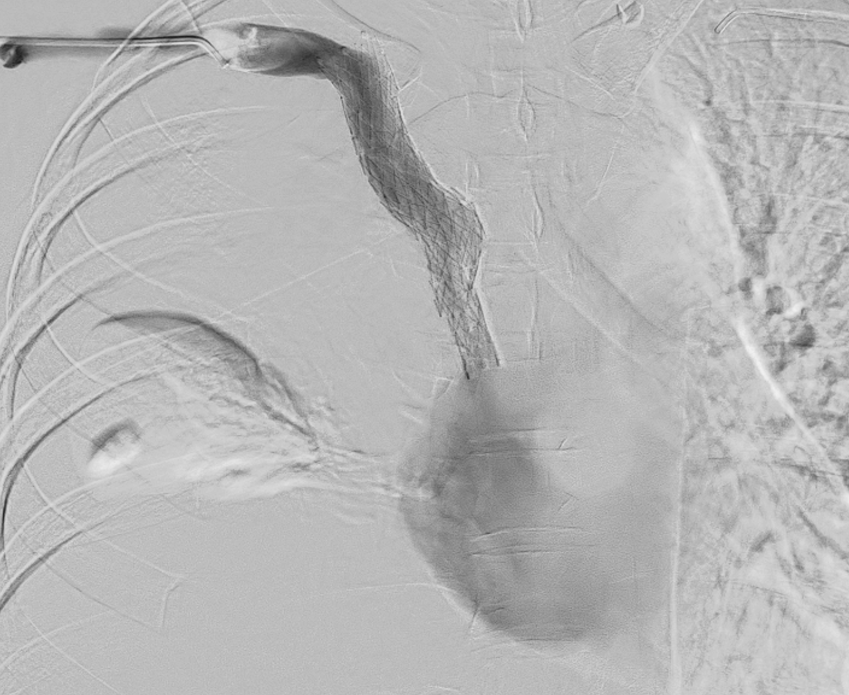
Paciente 3
Mujer de 61 años, en tratamiento quimioterápico a través de catéter venoso central con reservorio por enfermedad oncológica. Presenta de forma aguda disnea con estridor, edematización significativa cervico-facial y de miembro superior derecho.
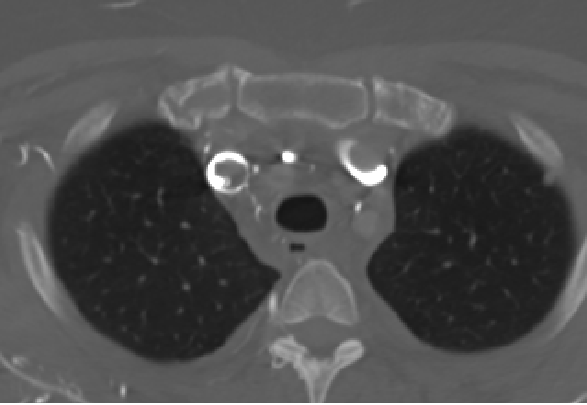
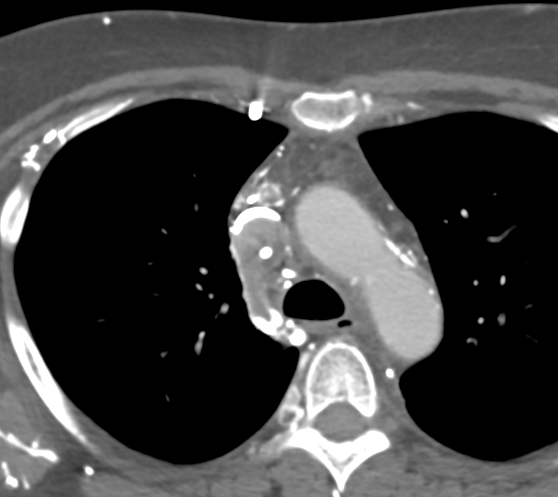
Se realiza Angio-TC donde se evidencia trombosis extensa que afecta a la vena cava superior, extendiéndose a la desembocadura de la vena ácigos y a ambos troncos venosos braquiocefálicos.
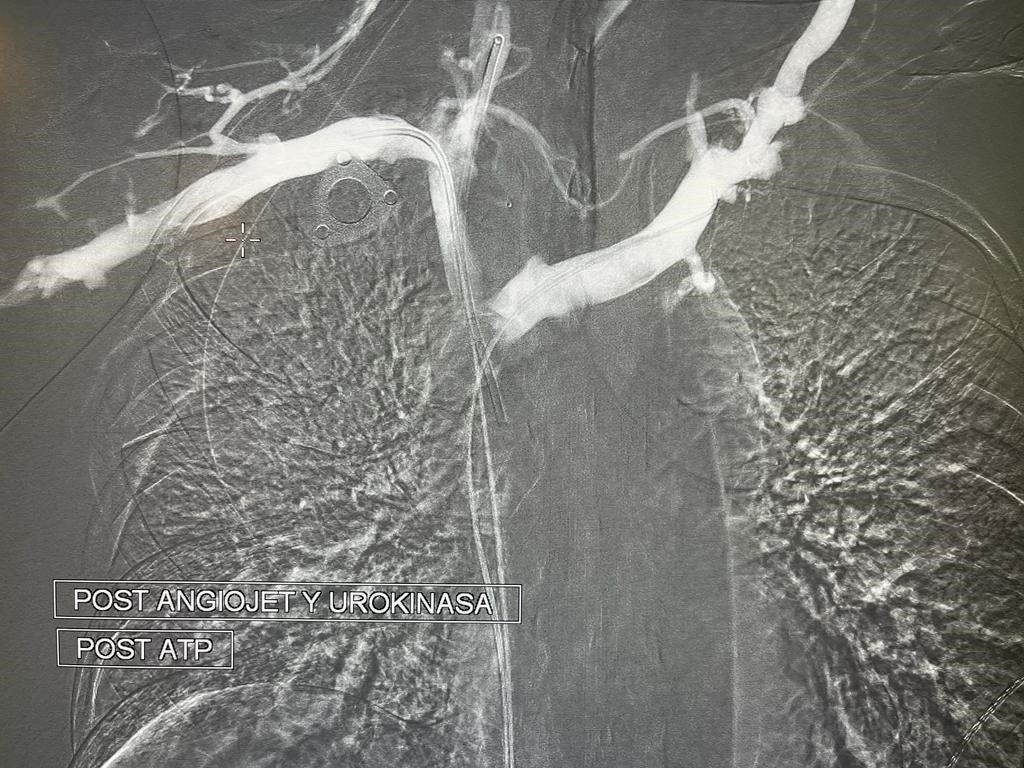
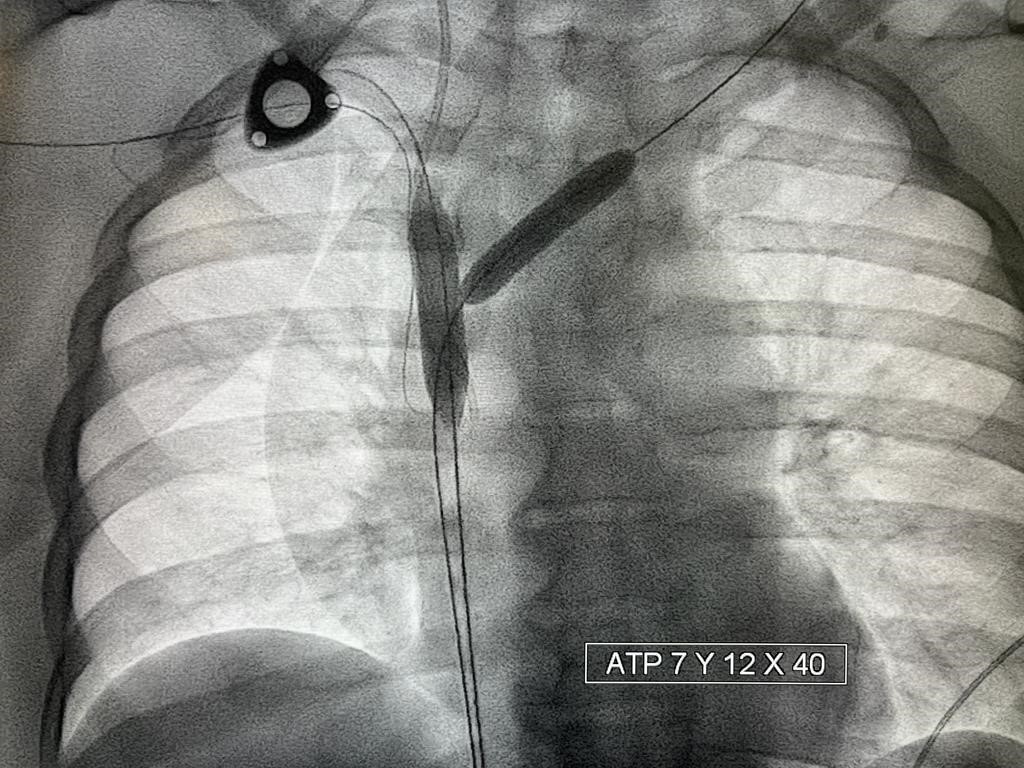
En primer lugar se realiza trombectomía fármaco mecánica mediante sistema Angiojet (Boston Scientific, Marlborough, Massachusetts, Estados Unidos) con protocolo ¨Power Pulse¨ (infusión de Urokinasa 300000 UI.) y posteriormente ¨Pulse Spray¨ con el fin de eliminar la mayor parte del fármaco fibrinolítico y de trombo. Posteriormente se realiza angioplastia progresiva para una mejor implantación de las endoprótesis.
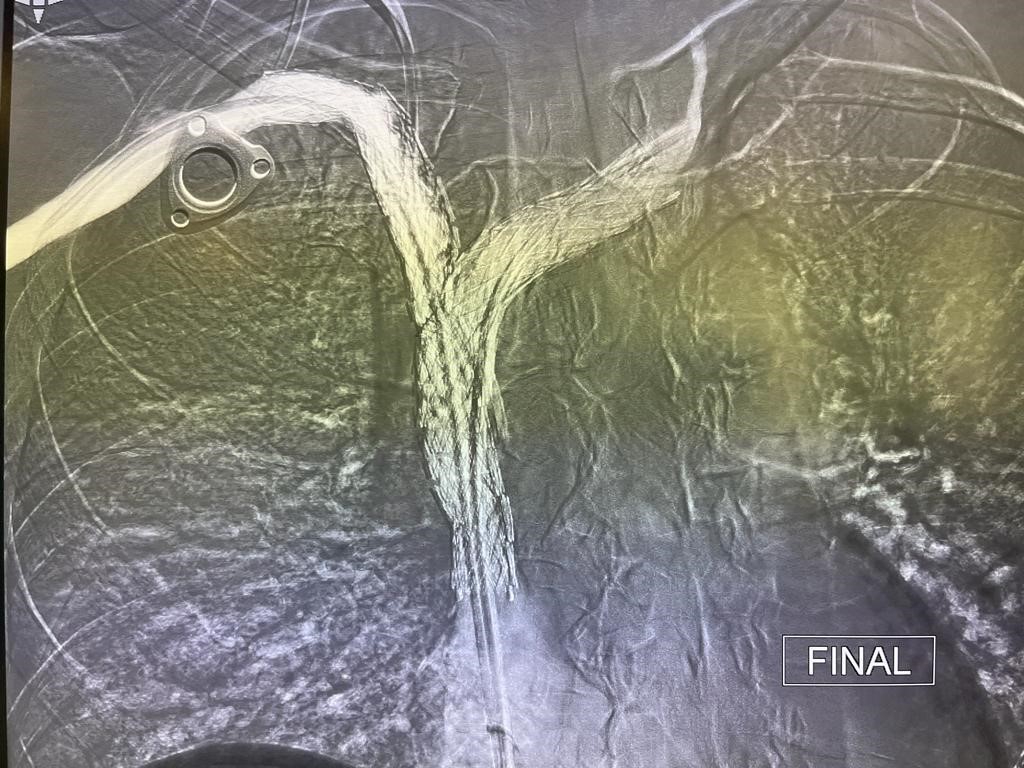
Se implantan dos endoprótesis metálicas en ¨Y¨ que se extienden desde ambos troncos venosos hasta VCS (Abre, Medtronic) obteniendo excelente resultado final con adecuado paso de contraste a cavidades cardíacas.
La paciente evoluciona favorablemente y puede continuar con su tratamiento quimioterápico
Bibliografía
[1] Rachapalli, Vamsidhar, y Louis-Martin Boucher. «Superior Vena Cava Syndrome: Role of the Interventionalist». Canadian Association of Radiologists Journal = Journal l’Association Canadienne Des Radiologistes, vol. 65, n.º 2, mayo de 2014, pp. 168-76. PubMed, https://doi.org/10.1016/j.carj.2012.09.003.
[2] Klein-Weigel, Peter Franz, et al. «Superior Vena Cava Syndrome». VASA. Zeitschrift Fur Gefasskrankheiten, vol. 49, n.º 6, octubre de 2020, pp. 437-48. PubMed, https://doi.org/10.1024/0301-1526/a000908.
[3] Azizi, Abdul Hussain, et al. «Superior Vena Cava Syndrome». JACC. Cardiovascular Interventions, vol. 13, n.o 24, diciembre de 2020, pp. 2896-910. PubMed, https://doi.org/10.1016/j.jcin.2020.08.038.
[4] Stanford, W., y D. B. Doty. «The Role of Venography and Surgery in the Management of Patients with Superior Vena Cava Obstruction». The Annals of Thoracic Surgery, vol. 41, n.o 2, febrero de 1986, pp. 158-63. PubMed, https://doi.org/10.1016/s0003-4975(10)62659-8.
[5] Yu, James B., et al. «Superior Vena Cava Syndrome—A Proposed Classification System and Algorithm for Management». Journal of Thoracic Oncology, vol. 3, n.º 8, agosto de 2008, pp. 811-14. www.jto.org, https://doi.org/10.1097/JTO.0b013e3181804791.
[6] Otten, Todd R., et al. «Thromboembolic Disease Involving the Superior Vena Cava and Brachiocephalic Veins». Chest, vol. 123, n.o 3, marzo de 2003, pp. 809-12. PubMed, https://doi.org/10.1378/chest.123.3.809.
[7] Kishi, K., et al. «Self-Expandable Metallic Stent Therapy for Superior Vena Cava Syndrome: Clinical Observations». Radiology, vol. 189, n.o 2, noviembre de 1993, pp. 531-35. PubMed, https://doi.org/10.1148/radiology.189.2.8210386.
[8] Fagedet, Dorothée, et al. «Endovascular Treatment of Malignant Superior Vena Cava Syndrome: Results and Predictive Factors of Clinical Efficacy». Cardiovascular and Interventional Radiology, vol. 36, n.o 1, febrero de 2013, pp. 140-49. PubMed, https://doi.org/10.1007/s00270-011-0310-z.
[9] Dake, Michael D., et al. «Three-Year Results from the Venovo Venous Stent Study for the Treatment of Iliac and Femoral Vein Obstruction». Cardiovascular and Interventional Radiology, vol. 44, n.o 12, diciembre de 2021, pp. 1918-29. PubMed, https://doi.org/10.1007/s00270-021-02975-2.
[10] Murphy, Erin, et al. «Pivotal Study Evaluating the Safety and Effectiveness of the Abre Venous Self-Expanding Stent System in Patients With Symptomatic Iliofemoral Venous Outflow Obstruction». Circulation. Cardiovascular Interventions, vol. 15, n.o 2, febrero de 2022, p. e010960. PubMed, https://doi.org/10.1161/CIRCINTERVENTIONS.121.010960.
[11] Friedman, Tamir, et al. «Malignant Venous Obstruction: Superior Vena Cava Syndrome and Beyond». Seminars in Interventional Radiology, vol. 34, n.o 4, diciembre de 2017, pp. 398-408. PubMed, https://doi.org/10.1055/s-0037-1608863.
[12] Aung, Eri Yin-Soe, et al. «Endovascular Stenting in Superior Vena Cava Syndrome: A Systematic Review and Meta-Analysis». Cardiovascular and Interventional Radiology, vol. 45, n.o 9, septiembre de 2022, pp. 1236-54. PubMed, https://doi.org/10.1007/s00270-022-03178-z.
[13] Breault, Stéphane, et al. «Percutaneous Endovascular Management of Chronic Superior Vena Cava Syndrome of Benign Causes : Long-Term Follow-Up». European Radiology, vol. 27, n.o 1, enero de 2017, pp. 97-104. PubMed, https://doi.org/10.1007/s00330-016-4354-y.
[14] Uberoi, Raman. «Quality Assurance Guidelines for Superior Vena Cava Stenting in Malignant Disease». CardioVascular and Interventional Radiology, vol. 29, n.o 3, junio de 2006, pp. 319-22. Springer Link, https://doi.org/10.1007/s00270-005-0284-9.
[15] Nguyen, N. P., et al. «Safety and Effectiveness of Vascular Endoprosthesis for Malignant Superior Vena Cava Syndrome». Thorax, vol. 64, n.o 2, febrero de 2009, pp. 174-78. thorax.bmj.com, https://doi.org/10.1136/thx.2007.086017.