Introducción
La tromboembolia pulmonar es la tercera enfermedad cardiovascular más frecuente, afectando al 5% de las personas en algún momento de su vida. Según Dalen et al, un diagnóstico y tratamiento temprano resulta en una mortalidad del 8%, mientras que un enfoque tardío eleva la cifra al 30%. La mayoría de trombos pulmonares provienen de las extremidades inferiores, seguido por las superiores y cuello en individuos con catéteres venosos. Estos trombos también pueden formarse por diversas causas p.ej: la anemia falciforme y estar compuestos por varios elementos. Los factores relacionados con la triada de Virchow son variados, incluyendo anticonceptivos, cáncer y reposo prolongado. Los síntomas de la enfermedad no son específicos, pero los criterios de Wells y Ginebra son útiles para evaluar su probabilidad clínica. En la última década, la terapia dirigida por catéter ha ganado relevancia en ciertos casos, destacando la importancia de un diagnóstico rápido debido a la alta mortalidad en pacientes con inestabilidad hemodinámica (mayor al 5%).
Actualmente, se favorece la fibrinolisis sistémica en pacientes de alto riesgo vs la local junto con la fragmentación con catéter. Kuo et al. ven estas técnicas como preferenciales en centros avanzados, respaldado por una experiencia. Uno de los artículos base para este fundamento es de Vertstraete et al. publicado en Circulation en 1988. Una de las más importantes limitaciones del estudio de Verstraete fue el bajo número de pacientes y el reclutamiento de pacientes por centro que supone un promedio de 4 por centro. La administración del fibrinolítico en el tronco de la arteria pulmonar sin atravesar el trombo y la no fragmentación del mismo constituyeron otras importantes limitaciones.
Criterios de inclusión para pacientes con EP masiva (Alto riesgo)
Pacientes provenientes de la Unidad de Cuidados Intensivos.
Síntomas agudos de EP de menos de 14 días.
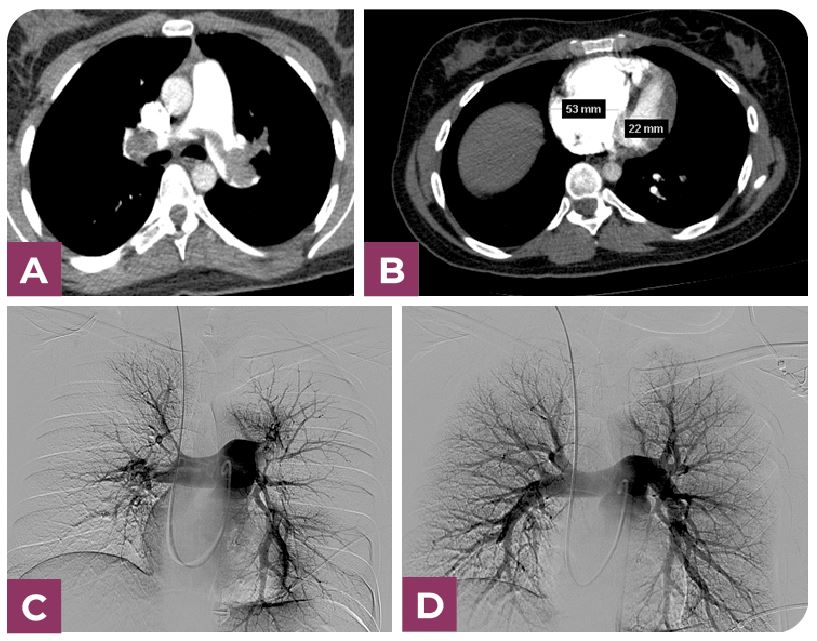
Defectos de repleción importantes intraluminales mediante angiotomografía computarizada multidetector (angioTCMD).
Los pacientes deben tener una tensión arterial sistólica inferior a 90 mm Hg, y esta condición debe mantenerse durante más de 15 minutos.
Puede ser necesario que el paciente requiera el uso de drogas inotrópicas.
Deben presentar disfunción ventricular derecha por ecocardiografía.
Criterios de exclusión
Riesgo intermedio bajo, intermedio alto y bajo, riesgo alto con adecuada respuesta a tratamiento fibrinolítico.
Rechazar la firma del consentimiento informado.
Como instrumento de recolección de datos, se hizo una revisión de los expedientes clínicos del servicio de radiología intervencionista en el periodo del estudio. Se introdujo la información clínica de los pacientes, las presiones arteriales antes y después de procedimiento, así como valores de TAPSE e índice de Qandalli y los detalles técnicos del procedimiento.
Técnica
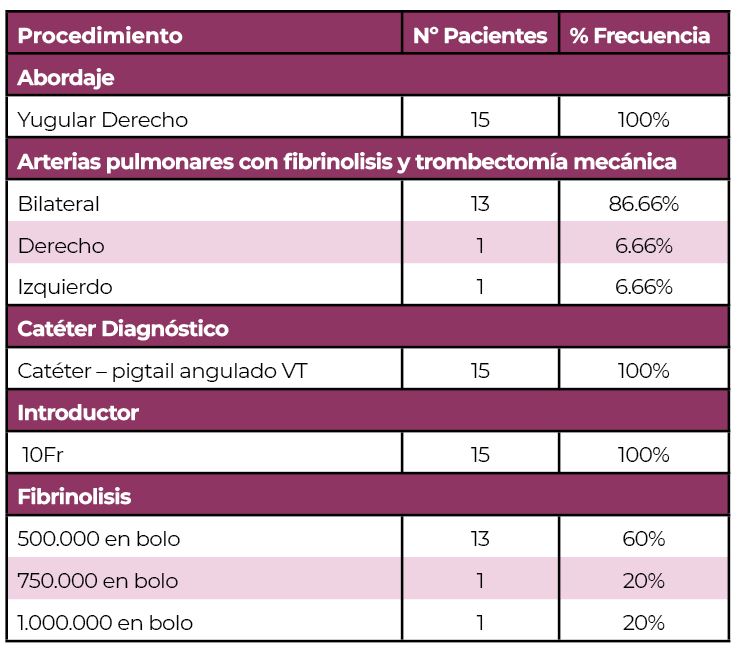
Todos los procedimientos fueron realizados por el mismo equipo médico y de enfermería de hospital Quirón Salud Zaragoza. El acceso vascular utilizado fue la vena yugular interna derecha. Se empleo introductor 12F de 13cm (Cook Medical. Blomington, USA).
Se realizo cavografía mediante catéter pigtail 5fr (Merit Medical, South Jordan Utah) y guía hidrofílica 0.035 pulgadas de 150cm (Hidrophilic Guide Wires Merit Laureate Parkway USA) con posterior administración de iopamiro 370 (Bracco, Milán Italia) con inyector a 20 ml por 10ml/s. y posterior colocación de filtro de Vena Cava mediante sistema de colocación de filtro celect (Cook Medical. Blomington, USA).
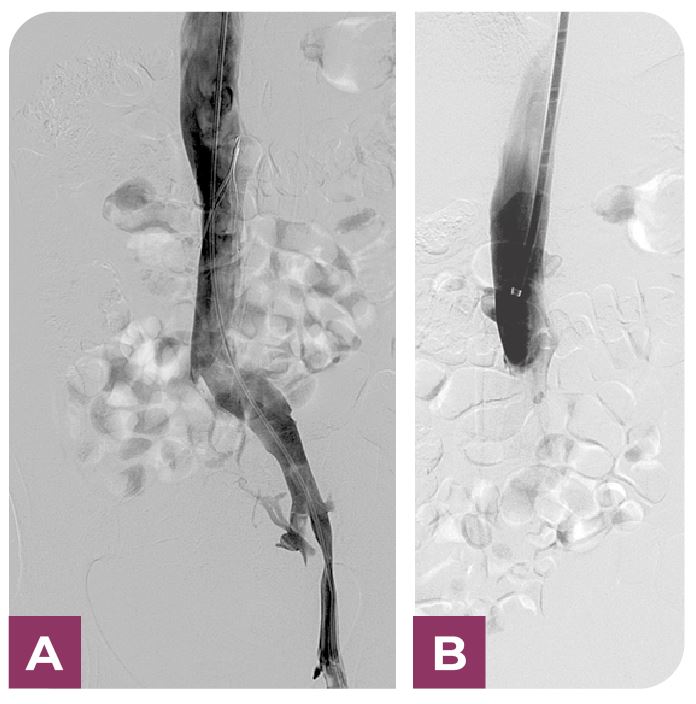
Se cateterizó la arteria pulmonar mediante catéter pigtail 5F angulado tipo VT (Merit Medical, South Jordan Utah) y guia hidrofílica 0.0335/150cm con posterior medición de presión sistólica, media y diastólica. Posteriormente se les efectuó un procedimiento para fragmentar las obstrucciones más grandes utilizando movimientos circulares con un catéter especializado (5 F catéter pig-tail curvado de 100 cm. Cook Europe ApS, Bjaeverskov, Dennmark). Luego, se administró una solución de uroquinasa (Urokinase Vedim, Vedim Pharma, Barcelona, España) a un ritmo de 100.000 UI/h durante aproximadamente 12 horas a través de un catéter posicionado en el segmento arterial más obstruido. Se efectuaron revisiones de posibles puntos de sangrado, monitorización de la presión arterial. Basados en esta información, se determinó si continuar el tratamiento por 12 horas adicionales o finalizarlo.
Mientras se realizaba la trombólisis, se administró heparina sódica a todos los pacientes, ajustando la dosis para obtener valores de ATTP entre 2 y 2,5, con el objetivo de prevenir la acumulación o crecimiento de fibrina en los coágulos existentes y en el catéter utilizado (Fig. 2).
El objetivo fue disminuir la carga trombótica considerándose exitoso en caso de eliminación de la carga trombótica entre el 90 a 50% o reducción del índice de Miller menor a 17 puntos asociado a mejoría en las presiones de la arteria pulmonar (sistólica y media) arriba de 10 mmHg y aurícula derecha (media). Mejoría en saturación de oxígeno.
En relación a la carga trombótica residual dejamos una infusión de uroquinasa (100.000UI) durante 4-12 horas o 2200 UI/Kg hora). Se paso los pacientes a UCI y el equipo médico anti coaguló mediante heparina no fraccionada (HNF) 80 UI por kg de peso con TTP en ratio 1,5-2,5 veces seguido de una infusión de 18 UI/Kg/hora. Dependiendo si se dejo un catéter pigtail en la arteria pulmonar se realiza control para retirada o continuar 12 horas más la fibrinolisis.
Discusión
La restauración rápida del flujo pulmonar es vital para reducir la mortalidad y mejorar la hemodinámica del paciente. La combinación de fragmentación mecánica del trombo arterial pulmonar y trombólisis farmacológica ha demostrado ser una opción efectiva para restaurar este flujo. La fragmentación mecánica permite una rápida recanalización de las arterias pulmonares y la dispersión del coágulo, lo que mejora la presión arterial pulmonar y el flujo vascular. Esta técnica también aumenta el área del trombo expuesta al agente fibrinolítico, potenciando su efecto. Se han utilizado varios agentes farmacológicos para la trombólisis arterial pulmonar y hay dos métodos de administración: sistémica y intraarterial pulmonar.
Se han descrito balones de dilatación vascular o catéteres pig-tail, para fragmentar trombos en la arteria pulmonar demostrando estabilizar rápidamente la situación hemodinámica, con resultados superiores a solo la fibrinólisis farmacológica. Esta fragmentación dispersa el trombo central, mejorando la perfusión pulmonar y, por ende, reduciendo la presión pulmonar y aumentando la superficie de contacto con el fibrinolítico. La fragmentación mecánica puede ser especialmente beneficiosa para pacientes con contraindicaciones para el tratamiento fibrinolítico que enfrentan un TEP masivo con inestabilidad hemodinámica.
La intervención inmediata es crucial para mejorar los resultados, y la terapia dirigida por catéter (CDT) ha surgido como una alternativa prometedora brindando varias ventajas clave:
- Reducción de la dosis sistémica de agentes trombolíticos: La administración localizada permite la utilización de dosis menores de trombolíticos, reduciendo el riesgo de sangrado, un efecto adverso significativo asociado con la trombólisis sistémica (Kucher, 2015).
- Lisis efectiva del trombo: La administración directa de agentes trombolíticos al sitio del trombo puede resultar en una lisis más efectiva y rápida. Esto es especialmente beneficioso en obstrucciones masivas donde la restauración del flujo es crítica (Engelhardt et al., 2018).
- Menor riesgo de hipertensión pulmonar crónica: La rápida y efectiva eliminación del trombo puede reducir el riesgo de hipertensión pulmonar tromboembólica crónica, una complicación a largo plazo del TEP (Tapson et al., 2017).
- Preservación de la función cardíaca: En comparación con el tratamiento anticoagulante solo, la TDC ha demostrado mejorar la función del ventrículo derecho, lo que se traduce en una mejoría hemodinámica y, potencialmente, en un mejor pronóstico a largo plazo (Piazza & Goldhaber, 2010).
- Versatilidad: Aparte de la trombólisis, los catéteres permiten técnicas de embolectomía mecánica, proporcionando otra modalidad terapéutica en caso de contraindicaciones para agentes trombolíticos (Chamsuddin et al., 2012).
Además, para los pacientes que tienen contraindicaciones a la trombólisis sistémica, la CDT puede ofrecer una intervención alternativa. Los estudios han sugerido que la CDT puede llevar a una mejora hemodinámica rápida y reducir la tensión en el ventrículo derecho, un factor crítico en el pronóstico del TEP.
Sin embargo, como todas las intervenciones, la CDT no está exenta de riesgos. Estos incluyen complicaciones en el sitio de acceso, hemorragias e incluso potencial migración del trombo. La selección adecuada del paciente y la técnica son cruciales.
Aunque desde 2009 (ACCP), 2019 (ESC) hasta ahora se ha establecido el tratamiento fibrinolítico sistémico como primera opción para pacientes con TEP de alto riesgo. Sin embargo, existe controversia al respecto: Schmitz-Rode et al realizaron un estudio in vitro donde encontraron que la perfusión de fibrinolíticos cerca de un trombo no ofrece ventajas sobre la perfusión sistémica, pero la infusión directamente en el trombo sí provoca una fragmentación efectiva. (31).
Tapson et al mediante un modelo animal en 1994, evidenciaron que la trombolisis local es más eficiente y rápida debido a la mejor exposición del medicamento a la superficie del trombo. Fava et al trataron a 17 pacientes con EPm combinando trombolisis farmacológica con fragmentación mecánica, logrando una mejoría del 88% en las primeras horas. Según ellos, la meta terapéutica principal en EPm es restaurar la circulación pulmonar, y sostienen que la combinación de fragmentación y fibrinolíticos lo logra rápidamente en un alto porcentaje de casos.
Nakazawa et al mencionan que la fragmentación puede incrementar la presión pulmonar al causar embolización distal, aunque otros autores discrepan. Greenberg et al, en un estudio in vitro, concluyen que la fragmentación estabiliza el flujo rápidamente y crea pequeños trombos que son reducidos por agentes fibrinolíticos.
De Gregorio et al en 2001, 2002 y 2011, demostraron usando trombolisis y fragmentación, obteniendo una mejoría clínica importante y una disminución significativa de la presión arterial pulmonar. Proponiendo que el principal beneficio de la fragmentación es que crea una mayor superficie para la acción de la uroquinasa.
Basado en la evidencia previa se ha fundamentado la decisión de terapia dirigida por catéter como tratamiento de primera línea en pacientes de alto riesgo pese a las recomendaciones actuales y previas desde hace ya varios años administrando por vía intraarterial pulmonar, extendiendo la infusión del medicamento.
Conclusiones
El tromboembolismo pulmonar (TEP) con riesgo alto presenta un desafío clínico, dado el potencial de deterioro hemodinámico y mortalidad asociada. La elección entre el tratamiento fibrinolítico sistémico y la terapia dirigida por catéter (TDC) es una cuestión central en la gestión de estos pacientes. La TDC ofrece la ventaja de administrar agentes trombolíticos directamente al sitio del trombo, lo que potencialmente reduce la dosis total requerida y, por lo tanto, el riesgo de hemorragia sistémica. Además, ciertos dispositivos permiten la aspiración o fragmentación mecánica del trombo (Kuo et al., 2013).
En resumen, la fragmentación mecánica y terapia trombolítica en pacientes de alto riesgo representa una alternativa terapéutica para pacientes con TEP severo. La supervivencia de estos pacientes se vincula directamente con la prontitud en restaurar el flujo pulmonar y aliviar el esfuerzo del corazón derecho. Nuestros hallazgos respaldan la efectividad y seguridad de esta combinación en el manejo del TEP grave con impacto hemodinámico, ofreciendo alivio sintomático y reducción de la presión pulmonar. Consideramos que, para validar plenamente este enfoque como tratamiento de primera elección, se requieren más investigaciones sistemáticas comparadas con la fibrinolisis sistémica como preferencia.
Bibliografía
- De Gregorio et al. 2010. Tratamiento endovascular mediante fibrinolisis y fragmentación del embolismo pulmonar masivo con inestabilidad hemodinámica. Experiencia de un solo centro en 111 pacientes. ¿Por qué no seguimos las recomendaciones de la ACCP? Archivos de bronconeumología, Vol. 47, Nº. 1, 2011, págs. 17-24.
- Kuo, W. T., et al. (2015). Catheter-directed therapy for the treatment of massive pulmonary embolism: systematic review and meta-analysis of modern techniques. Journal of Vascular and Interventional Radiology, 20(11), 1431-1440.Kuo, W. T., Banerjee, A., & Kim, P. S. (2013). Pulmonary embolism response to fragmentation, embolectomy, and catheter thrombolysis (PERFECT): Initial results from a prospective multicenter registry. Chest, 144(2), 667-673.
- De Gregorio M, Gimeno M, Alfonso R, Medrano J, Loyola S, Fava M, et al. Mechanical fragmentation and intrapulmonary fibrinolysis in the treatment of massive pulmonary embolism hemodynamic repercussions. Arch Bronconeumol. 2001;37:58–64.
- De Gregorio MA, Fava M. Fragmentation and fibrinolysis in pulmonary thromboembolism. Arch Bronconeumol. 2001;37:513.
- Fava M, Loyola S, Flores P, Huete I. Mechanical fragmentation and pharmacologic thrombolysis in massive pulmonary embolism. J Vasc Interv Radiol. 1997;8:261–6.



